El reciente estudio publicado en 2023 por Gordon y cols. en la revista Nature actualiza la estructura y la función de la corteza motora primaria (M1) respecto al control del movimiento voluntario. En mi labor docente e investigadora, la información que aporta resulta fundamental para actualizar mis clases y por supuesto, la divulgación científica que ofrezco en este blog. A través de esta entrada, he tratado de interpretar y sintetizar la información más relevante del manuscrito con la consideración de otras referencias.
Todas las ilustraciones han sido elaboradas por el autor de la entrada.
La red neuronal del movimiento voluntario.
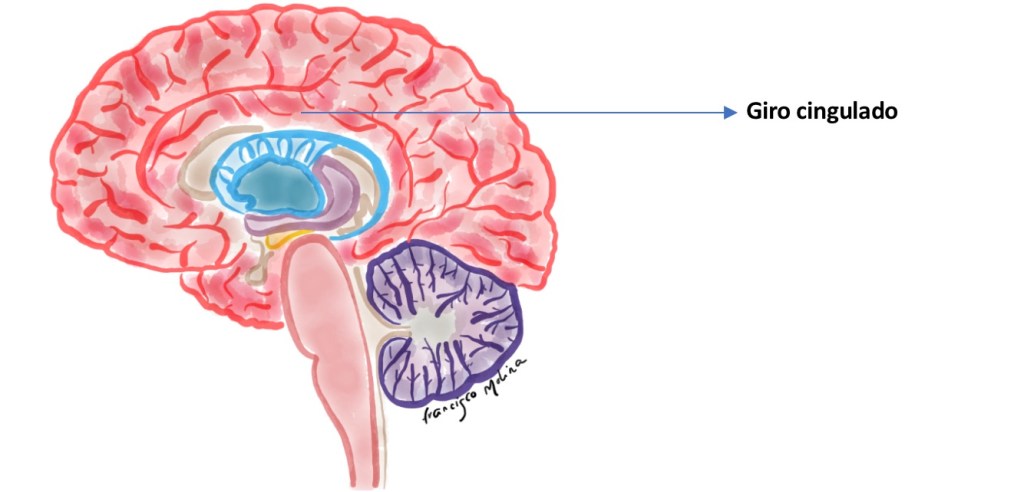
El procesamiento neural que subyace al control atencional del movimiento voluntario requiere de diferentes redes cerebrales tales como la red cíngulo-opercular (en adelante RCO) compuesta por la ínsula/opérculo anterior (figura 1), la corteza cingulada anterior dorsal (figura 2) y el tálamo (Sadaghiani y cols. 2015).
Figura 1. Ínsula. Como su nombre indica, se trata de una isla, un área circunscrita en la cisura de Silvio, no visible en la cara externa del cerebro, al estar cubierta por otras regiones corticales que se superponen. Estas áreas superpuestas se llaman opérculas y forman parte de los lóbulos frontal, parietal y temporal.
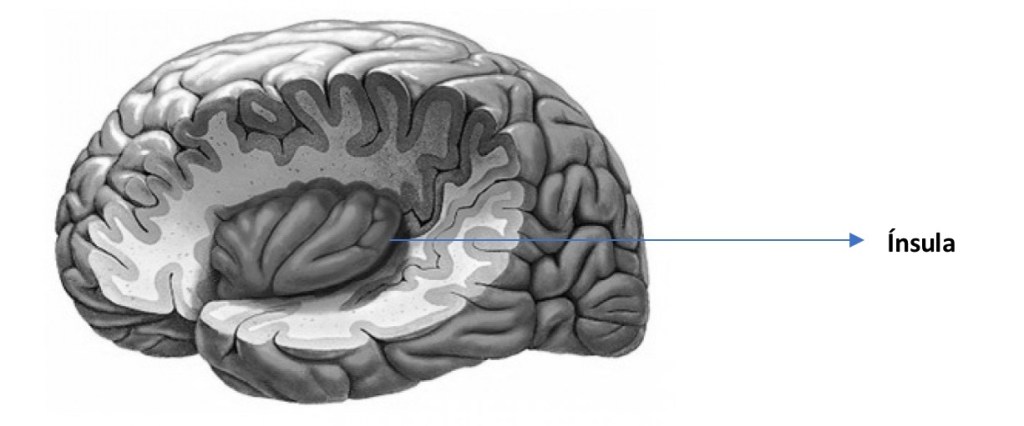
Figura 2. Giro cingulado o córtex cingulado. Localizado en la profundidad de la corteza, próximo al cuerpo calloso.
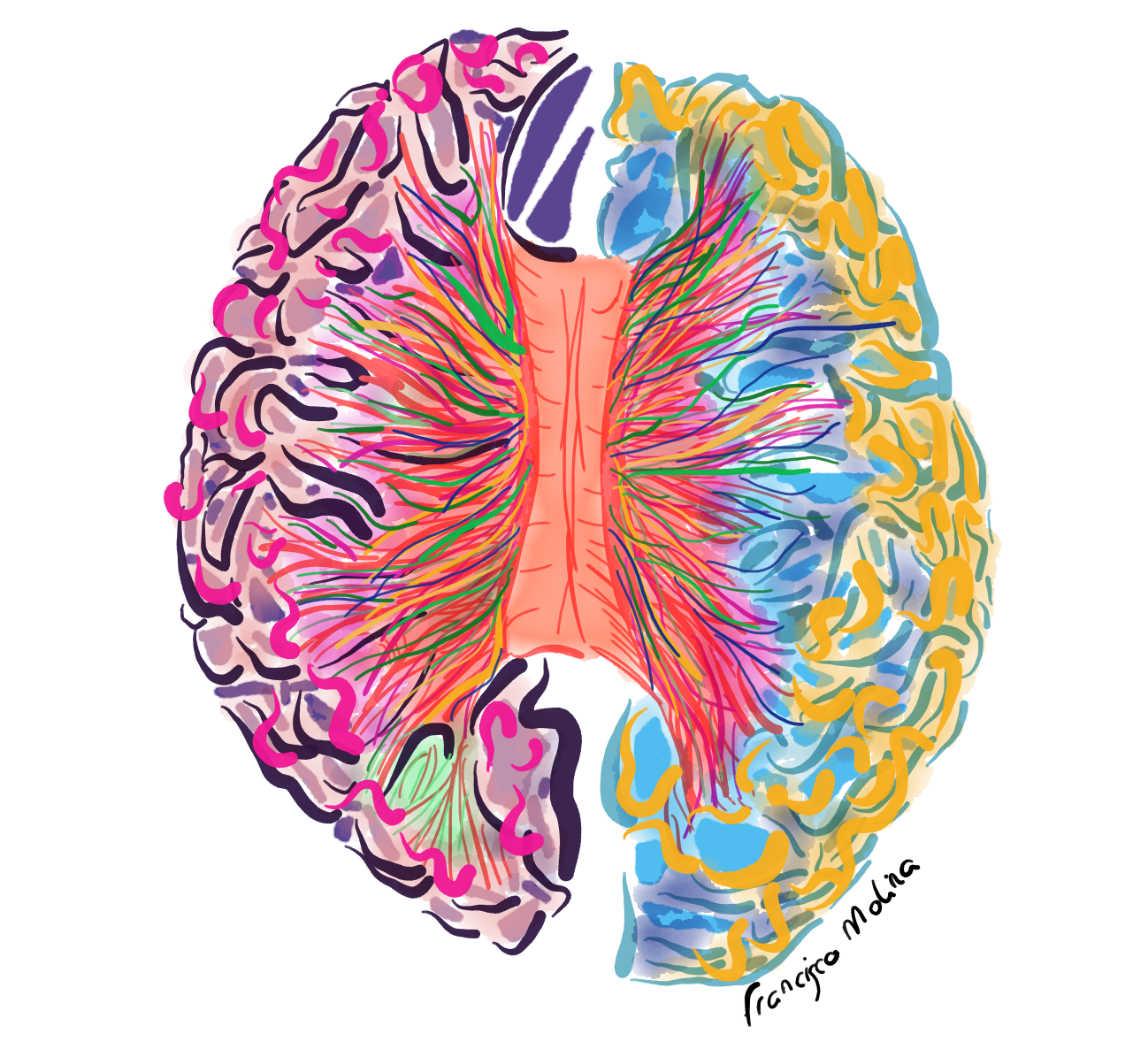
Los movimientos voluntarios son acciones dirigidas a objetivos, iniciadas y controladas por regiones ejecutivas en la RCO. La actividad neuronal que precede a los movimientos voluntarios se puede detectar primero en la corteza cingulada anterior dorsal, luego en el área motora pre-suplementaria y el área motora suplementaria, seguida por la corteza motora primaria. Todas estas regiones se proyectan hacia la médula espinal, siendo M1 el principal transmisor de órdenes motoras a lo largo del tracto corticoespinal.
Las copias motoras eferentes del acto motor son enviadas a la corteza somatosensorial primaria (S1), al cerebelo y al cuerpo estriado para la corrección en línea, el aprendizaje y la inhibición de los movimientos competitivos (Gordon y cols. 2023).
Sistemas visceral y musculoesquelético en la acción voluntaria.
La RCO parece tener conexiones con órganos internos (como la médula suprarrenal: producción de adrenalina y noradrenalina) para la activación simpática preparatoria de la acción motora. En concreto, existen relaciones entre las estructuras corticales y las neuronas preganglionares simpáticas en la médula espinal. En estas redes están involucradas neuronas de la formación reticular y de la sustancia gris periacueductal en el tronco del encéfalo (Dum y cols. 2016). Se trata, por tanto, de una posible relación entre el sistema motor volitivo (baja demanda atencional o cognitiva) y el sistema endocrino.
De esta manera, la generación de una acción motora lleva consigo una orden «predictiva» que prepara al cuerpo para satisfacer las necesidades metabólicas anticipadas de actividades como el ejercicio, los estados emocionales y la lucha o la huida. Por tanto, las órdenes centrales para preparar y generar un movimiento voluntario se originan en las mismas áreas corticales que están involucradas en la preparación y generación de la función visceromotora que necesita un movimiento. Se trata pues de un mecanismo que permite facilitar la coordinación de estos dos sistemas.
Homúnculo clásico y homúnculo “interrumpido”.
El hallazgo principal del artículo de Gordon y cols., además, de poner en evidencia la importancia de la RCO, es la demostración de una nueva organización cortical para la corteza motora primaria.
En este sentido, todos recordaréis que, la corteza motora primaria formaba un homúnculo somatotópico continuo que se extendía hacia la circunvolución precentral desde las representaciones del pie hasta la cara. Gordon y cols., que emplearon métodos de resonancia magnética funcional, observaron que, el homúnculo clásico está interrumpido por regiones con distinta conectividad, estructura y función, que se alternan con áreas efectoras específicas (pie, mano y boca) (figura 3).
Figura 3. Homúnculo “interrumpido”. Los esqueletos muestran las zonas interefectoras entre las áreas efectoras específicas.

Estas regiones interefectoras exhiben un espesor cortical disminuido y una fuerte conectividad funcional entre sí, así como con la RCO. Las zonas de integración parecen carecer de especificidad de movimiento y se activan durante la planificación de la acción (coordinación de extremidades) y el movimiento axial del cuerpo.
Por tanto, en M1, coexisten dos redes paralelas que se entrelazan: las regiones efectoras específicas (pie, mano y boca) responsables de los patrones de movimiento fino y las redes de acción somatocognitivas (SCAN, del inglés somato-cognitive action network), que integran la RCO y sus diversas conexiones, las cuales son esenciales en los procesos atencionales, cognitivos, integradores y metabólicos del movimiento corporal (figura 4).
La alta conectividad (por ejemplo, con estructuras contralesionales) de la red SCAN explica que los movimientos globales y las capacidades motoras gruesas se recuperen antes tras una lesión cerebral; mientras que, el control fino, que depende de áreas efectoras específicas (menos conectadas) tarda más en recomponerse. La lesión de la red SCAN afecta al movimiento autogenerado, es decir, a la intencionalidad del movimiento. Además, el daño en estas redes puede estar detrás de ciertos trastornos del movimiento, como las distonías y el templo esencial, o de inestabilidad postural, debido a su conexión con núcleo motores del tálamo y con el cerebelo (Gordon y cols.).
Figura 4. La red cíngulo-opercular y su relación con otras redes neuronales.

Términos clave:
Red cíngulo-opercular
Redes de acción somatocognitivas
Homúnculo interrumpido
Zonas interefectoras
Corteza motora primaria
Médula suprarrenal
Lecturas y referencias:
Sadaghiani S, D’Esposito M. Functional Characterization of the Cingulo-Opercular Network in the Maintenance of Tonic Alertness. Cereb Cortex. 2015 Sep;25(9):2763-73. doi: 10.1093/cercor/bhu072. Epub 2014 Apr 25. PMID: 24770711; PMCID: PMC4537431.
Gordon EM, Chauvin RJ, Van AN, Rajesh A, Nielsen A, Newbold DJ, Lynch CJ, Seider NA, Krimmel SR, Scheid Ter KM, Monk J, Miller RL, Metoki A, Montez DF, Zheng A, Elbau I, Madison T, Nishino T, Myers MJ, Kaplan S, Badke D’Andrea C, Demeter DV, Feigelis M, Ramirez JSB, Xu T, Barch DM, Smyser CD, Rogers CE, Zimmermann J, Botteron KN, Pruett JR, Willie JT, Brunner P, Shimony JS, Kay BP, Marek S, Norris SA, Gratton C, Sylvester CM, Power JD, Liston C, Greene DJ, Roland JL, Petersen SE, Raichle ME, Laumann TO, Fair DA, Dosenbach NUF. A somato-cognitive action network alternates with effector regions in motor cortex. Nature. 2023 May;617(7960):351-359. doi: 10.1038/s41586-023-05964-2. Epub 2023 Apr 19. PMID: 37076628; PMCID: PMC10172144.
Dum RP, Levinthal DJ, Strick PL. Motor, cognitive, and affective areas of the cerebral cortex influence the adrenal medulla. Proc Natl Acad Sci U S A. 2016 Aug 30;113(35):9922-7. doi: 10.1073/pnas.1605044113. Epub 2016 Aug 15. PMID: 27528671; PMCID: PMC5024624.